LAPORAN PRAKTIKUM ASAM BASA
I. Judul Praktikum
Larutan Asam Basa
II. Tujuan Percobaan
Menentukan pH larutan tak dikenal dengan menggunakan beberapa larutan indikator.
III. Dasar Teori
A. Teori Asam Basa
1.Teori Asam Basa Arrhenius
Sejak beabad-abad yang lalu, para pakar mendefinisikan asam dan basa berdasarkan sifat larutannya. Larutan asam mempunyai rasa masam dan bersifat korosif (merusak logam, marmer dan berbagai bahan lain), sedangkan larutan basa berasa agak pahit dan bersifat kaustik (licin, seperti bersabun).Konsep yang cukup memuaskan tentang asam dan basa, dan yang tetap diterima hingga sekarang, dikemukakan oleh Svante August Arrhenius (1859-1927) pada tahun 1884.
Asam
Menurut Arrhenius, asam adalah senyawa yang jika dilarutkan ke dalam air menghasilkan ion H+.
Sifat-sifat asam diantaranya adalah:
a. Terasa masam
b. Bersifat korosif (merusak logam, marmer, dan berbagai bahan lain)
c. Terionisasi menghasilkan ion H+
d. Memiliki pH < 7
e. Memerahkan lakmus biru
Contoh senyawa yang termasuk pada asam, yaitu:
¨ HCl
¨ H2SO4
¨ CH3COOH
¨ H3PO4
Basa
Menurut Arrhenius, basa adalah senyawa yang jika dilarutkan ke dalam air menghasilkan ion OH-.
Sifat-sifat basa diantaranya adalah:
a. Terasa pahit
b. Bersifat kaustik (licin seperti bersabun)
c. Terionisasi menghasilkan ion OH-
d. Memiliki pH > 7
e. Membirukan lakmus merah
Contoh senyawa yang termasuk pada basa, yaitu:
¨ NaOH
¨ Ba(OH)2
¨ NH4OH
¨ KOH
2. Teori Asam Basa Bronsted Lowry
Menurut Bronsted Lowry,asam adalah zat yang dapat memberi proton,sedangkan basa adalah zat yang dapat menerima proton. Jadi asam sebagai donor proton, basa sebagai akseptor proton.
Konsep asam basa ini lebih luas daripada teori asam basa Arrhenius karena:
1) Konsep asam basa Bronsted Lowry tidak terbatas dalam pelarut air,tetapi juga menjelaskan reaksi asam basa dalam pelarut lain atau bahkan reaksi tanpa pelarut.
2) Asam basa Bronsted Lowry dapat berupa kation atau anion.Konsep ini dapat menjelaskan sifat asam dari NH4Cl,di mana pembawa sifat asamnya adalah NH4+ yang dalam air dapat melepas proton.
3. Teori Asam Basa Lewis
Lewis memberikan pengertian asam dan basa berdasarkan serah terima pasangan elektron,yaitu:
Asam = akseptor pasangan elektron
Basa = donor pasangan elektron
Konsep ini dapat menjelaskan reaksi-reaksi yang bersuasana asam basa walaupun tidak melibatkan proton ion H+.
B. Konsep pH dan pOH
Kata pH berasal dari bahasa Prancis yaitu 'pouvoir Hydrogene', artinya 'tenaga hidrogen' yang menuju eksponensil. Sorensen (1868-1839) mengusulkan konsep pH agar memudahkan para kimiawan dalam mengukur dan mengukuti perubahan konsentrasi ion dalam suatu larutan. Menurut Sorensen pH merupakan fungsi logaritma negatif dari konsentrasi ion dalam suatu larutan dan dirumuskan sebagai berikut :
pH = – log [H+]
Semakin besar konsentrasi ion H+, nilai pH-nya semakin kecil. Sehingga dapat disimpulkan bahwa semakin kecil nilai pH, maka larutan itu semakin bersifat asam.
Ada pula kebalikan dari pH yaitu pOH. Yang diukur di sini bukanlah konsentrasi ion H+, melainkan konsentrasi ion OH-.
pOH = – log [OH-]
Hubungan antara pH dan pOH dapat dirumuskan menjadi:
pH + pOH = 14
pH atau derajat keasaman digunakan untuk menyatakan tingkat keasaman (atau ke basaanyang dimiliki oleh suatu larutan. Yang dimaksudkan "keasaman" di sini adalah konsentrasi ion hidrogen(H+) dalam pelarut air. Nilai pH berkisar dari 0 hingga 14. Suatu larutan dikatakan netral apabila memiliki nilai pH=7. Nilai pH>7 menunjukkan larutan memiliki sifat basa, sedangkan nilai pH<7 menunjukan keasaman.
Nilai pH 7 dikatakan netral karena pada air murni ion H+ terlarut dan ion OH- terlarut (sebagai tanda kebasaan) berada pada jumlah yang sama, yaitu 10-7 pada kesetimbangan
C. Indikator Asam Basa
Indikator adalah zat yang mengalami perubahan warna karena keberadaan asam atau basa. Para kimiawan memiliki banyak indikator yang akan berubah pada perubahan kecil pH.
1. Kertas Lakmus
Sifat asam atau basa suatu larutan dapat juga diidentifikasi menggunakan kertas lakmus. Ada dua jenis kertas lakmus yaitu:
a. Kertas lakmus warna biru. Di dalam larutan asam, warna kertas berubah menjadi merah, sedangkan di dalam larutan netral atau basa, warna kertas tidak berubah (tetap biru).
b. Kertas lakmus warna merah. Di dalam larutan basa, warna kertas berubah menjadi biru, sedangkan di dalam larutan netral atau asam, warna kertas tidak berubah (tetap merah).
2. Fenolftalein
Fenolftalein merupakan indikator lain yang biasa digunakan. Hingga beberapa tahun yang lalu, fenolftalein digunakan sebagai zat aktif pada obat pencahar. Fenolftalein jernih dan tidak berwarna di dalam larutan asam dan akan berwarna merah muda di dalam larutan basa. Indikator ini biasanya digunakan dalam proses titrasi, yaitu proses penentuan konsentrasi asam atau basa yang tidak diketahui berdasarkan reaksi dengan basa atau asam yang telah diketahui konsentrasinya.
Indikator Phenol phtalein dibuat dengan cara kondensasi anhidrida ftalein (asam ftalat) dengan fenol. Trayek pH 8,3 – 10,0 dengan warna asam yang tidak berwarna dan berwarna merah muda dalam larutan basa.
3. Metil merah
Metil Merah (Methyl Red ) adalah senyawa organik yang memiliki rumus kimia C15H15N3O2, senyawa ini banyak dipakai untuk indikator titrasi asam basa. Indikator ini berwarna merah pada pH dibawah 4,2 dan berwarna kuning diatas 6,3. Warna transisinya menghasilkan warna orange.
4. Methyl Orange (MO).
Indikator MO merupakan indikator asam-basa yang berwarna merah dalam suasana asam dan berwarna jingga dalam suasana basa, dengan trayek pH 2,9 – 4,0.Pada kasus jingga metil, pada setengah tingkat dimana campuran merah dan kuning menghasilkan warna jingga.
5. Brom Timol Biru (BTB)
Indikator BTB atau brom timol biru dalam larutan asam berwarna kuning dan dalam larutan basa berwarna biru. Warna dalam keadaan asam disebut warna asam dan warna dalam keadaan basa disebut warna basa. Trayek pH pada 6,0 – 7,6.
IV. Alat dan Bahan
A. Alat
· Rak tabung reaksi : 1 buah
· Tabung reaksi : 4 buah
· Pipet tetes : 4 buah
· Gelas ukur : 1 buah
B. Bahan
· Indikator Metil Merah
· Indikator Metil Jingga
· Indikator Brom timol biru
· Indikator Fenolftalein
· Larutan A, B, C, D dan E
V. Prosedur Pengerjaan
1. Memasukkan larutan A ke dalam 4 tabung reaksi- masing 3 ml. Tandai tabung reaksi.
2. Menambahkan larutan indikator :
Tabung 1 tambahkan 2 tetes indicator metil merah
Tabung 2 tambahkan 2 tetes indicator metil jingga
Tabung 3 tambahkan 2 tetes indicator brom timol biru
Tabung 4 tambahkan 2 tetes indicator fenolftalein
Mengamati perubahan warna pada masing – masing tabung reaksi kemudian memperkirakan pH larutan A.
3. Melakukan langkah yang sama untuk larutan B, C, D dan E
Trayek Perubahan warna dari beberapa indicator
|
Indikator |
Trayek perubahan warna |
Perubahan warna |
|
Metil jingga Metil merah Brom timol biru Fenolftalein |
2,9 – 4,0 4,2 – 6,3 6,0 – 7,6 8,3 – 10,0 |
Merah – kuning Merah – kuning Kuning – biru Tidak berwarna - merah |
VI. Hasil Percobaan
|
No |
Larutan |
Indikator |
pH laruran |
||||
|
Metil merah |
Metil jingga |
Brom timol biru |
Fenolftalein |
||||
|
1 |
Larutan A |
warna |
kuning |
jingga |
Biru |
Tak berwarna |
|
|
pH |
>6,3 |
2,9<pH<4,0 |
>7,6 |
<8,3 |
7,6 <pH<8,3 |
||
|
2 |
Larutan B |
warna |
Merah |
merah |
Biru |
Tak warna |
|
|
pH |
<4,2 |
<2,9 |
>7,6 |
<8,3 |
<2,9 |
||
|
3 |
Larutan C |
warna |
Merah |
merah |
kuning |
Tak berwarna |
|
|
pH |
<4,2 |
<2,9 |
<6,0 |
<8,3 |
<2,9 |
||
|
4 |
Larutan D |
warna |
Kuning |
Jingga |
Biru |
Merah muda |
|
|
pH |
>6,3 |
2,9<pH<4,0 |
>7,6 |
8,3<pH<10 |
8,3<pH<10 |
||
|
5 |
Larutan E |
warna |
kuning |
jingga |
biru |
Merah |
|
|
pH |
>6,3 |
2,9<pH<4,0 |
>7,6 |
>10 |
>10 |
||
VII. Analisis Data
· Larutan A
Keempat tabung reaksi masing - masing diberi larutan A sebanyak 3 ml. Kemudian pada setiap tabung reaksi diberi indikator yang berbeda.
Pada tabung reaksi pertama ditetesi oleh indikator metil merah sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan A berubah warna menjadi kuning. Perubahan warna tersebut menandakan pH larutan >6,3 saat diuji pada indikator metil merah.
Pada tabung reaksi kedua ditetesi oleh indikator metil jingga sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan A berubah warna menjadi jingga. Perubahan warna tersebut menandakan pH larutan 2,9<pH<4,0 saat diuji pada indikatormetil jingga.
Pada tabung reaksi ketiga ditetesi oleh indikator bromtimol biru sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan A berubah warna menjadi biru. Perubahan warna tersebut menandakan pH larutan >7,6 saat diuji pada indikator bromtimol biru.
Pada tabung reaksi keempat ditetesi oleh indikator fenolftalein sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan A tetap tidak berwarna. Hal tersebut menandakan pH larutan <8,3 saat diuji pada indikator fenolftalein.
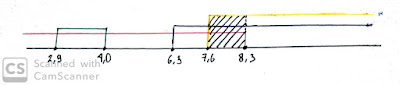
Dari data tersebut didapat range pH yang berbeda - beda antara satu indikator dengan indikator lain. Sehingga dari uji larutan dengan beberapa indikator, akan diperoleh daerah irisan pH larutan (dengan menggunakan garis bilangan). Daerah irisan tersebut menyatakan pH dari larutan A.
Dengan demikian, dapat disimpulkan pH larutan A pada percobaan kami yaitu 7,6<pH< 8,3. Dan karena larutan A memiliki trayek pH 7,6 sampai 8,3 maka termasuk basa lemah.
· Larutan B
Sama seperti larutan A, larutan B juga dimasukkan ke dalam tabung reaksi (sebanyak 3 ml ) dan diberi 4 indikator:
Pada tabung reaksi pertama ditetesi oleh indikator metil merah sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan B berubah warna menjadi merah. Perubahan warna tersebut menandakan pH larutan <4,2 saat diuji pada indikatormetil merah.
Pada tabung reaksi kedua ditetesi oleh indikator metil jingga sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan B berubah warna menjadi merah. Perubahan warna tersebut menandakan pH larutan <2,9 saat diuji pada indikator metil jingga.
Pada tabung reaksi ketiga ditetesi oleh indikator bromtimol biru sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan B berubah warna menjadi biru. Perubahan warna tersebut menandakan pH larutan >7,6 saat diuji pada indikator bromtimol biru.
Pada tabung reaksi keempat ditetesi oleh indikator fenolftalein sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan B tetap tidak berwarna. Hal tersebut menandakan pH larutan <8,3 saat diuji pada indikator fenolftalein.
Dari uji larutan dengan beberapa indikator, akan diperoleh daerah irisan pH larutan (dengan menggunakan garis bilangan). Daerah irisan tersebut menyatakan pH dari larutan B.
Dengan demikian, dapat disimpulkan pH larutan B pada percobaan kami yaitu <2,9. Dan karena larutan B memiliki pH <2,9 maka termasuk asam kuat.
· Larutan C
Sama seperti larutan sebelumnya, larutan C juga dimasukkan ke dalam tabung reaksi (sebanyak 3 ml ) dan diberi 4 indikator:
Pada tabung reaksi pertama ditetesi oleh indikator metil merah sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan C berubah warna menjadi merah. Perubahan warna tersebut menandakan pH larutan <4,2 saat diuji pada indikatormetil merah.
Pada tabung reaksi kedua ditetesi oleh indikator metil jingga sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan C berubah warna menjadi merah. Perubahan warna tersebut menandakan pH larutan <2,9 saat diuji pada indikatormetil jingga.
Pada tabung reaksi ketiga ditetesi oleh indikator bromtimol biru sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan C berubah warna menjadi kuning. Perubahan warna tersebut menandakan pH larutan <6,0 saat diuji pada indikator bromtimol biru.
Pada tabung reaksi keempat ditetesi oleh indikator fenolftalein sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan C tetap tidak berwarna. Hal tersebut menandakan pH larutan <8,3 saat diuji pada indikator fenolftalein.
Dari uji larutan dengan beberapa indikator, akan diperoleh daerah irisan pH larutan (dengan menggunakan garis bilangan). Daerah irisan tersebut menyatakan pH dari larutan C.
Dengan demikian, dapat disimpulkan pH larutan C pada percobaan kami yaitu <2,9. Dan karena larutan C memiliki pH <2,9 maka termasuk asam kuat.
· Larutan D
Sama seperti larutan sebelumnya, larutan D juga dimasukkan ke dalam tabung reaksi (sebanyak 3 ml ) dan diberi 4 indikator:
Pada tabung reaksi pertama ditetesi oleh indikator metil merah sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan D berubah warna menjadi kuning. Perubahan warna tersebut menandakan pH larutan >6,3 saat diuji pada indikatormetil merah.
Pada tabung reaksi kedua ditetesi oleh indikator metil jingga sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan D berubah warna menjadi jingga. Perubahan warna tersebut menandakan pH larutan 2,9<PH<4,0 saat diuji pada indikatormetil jingga.
Pada tabung reaksi ketiga ditetesi oleh indikator bromtimol biru sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan D berubah warna menjadi biru. Perubahan warna tersebut menandakan pH larutan >7,6 saat diuji pada indikator bromtimol biru.
Pada tabung reaksi keempat ditetesi oleh indikator fenolftalein sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan D berubah warna menjadi merah muda. Hal tersebut menandakan trayek pH larutan 8,3<pH<10 saat diuji pada indikator fenolftalein.
Dari uji larutan dengan beberapa indikator, akan diperoleh daerah irisan pH larutan (dengan menggunakan garis bilangan). Daerah irisan tersebut menyatakan pH dari larutan D.
Dengan demikian, dapat disimpulkan
pH larutan B pada percobaan kami yaitu 8,3<pH<10. Dan karena larutan D memiliki
pH 8,3 sampai 10 maka termasuk basa lemah. 
· Larutan E
Sama seperti larutan sebelumnya, larutan D juga dimasukkan ke dalam tabung reaksi (sebanyak 3 ml ) dan diberi 4 indikator:
Pada tabung reaksi pertama ditetesi oleh indikator metil merah sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan E berubah warna menjadi kuning. Perubahan warna tersebut menandakan trayek pH larutan >6,3 saat diuji pada indikatormetil merah.
Pada tabung reaksi kedua ditetesi oleh indikator metil jingga sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan E berubah warna menjadi jingga. Perubahan warna tersebut menandakan pH larutan 2,9<PH<4,0 saat diuji pada indikatormetil jingga.
Pada tabung reaksi ketiga ditetesi oleh indikator bromtimol biru sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan D berubah warna menjadi biru. Perubahan warna tersebut menandakan pH larutan >7,6 saat diuji pada indikator bromtimol biru.
Pada tabung reaksi keempat ditetesi oleh indikator fenolftalein sebanyak 2 tetes. Dan setelah ditetesi oleh indikator tersebut, larutan D berubah warna menjadi merah . Hal tersebut menandakan trayek pH larutan <10 saat diuji pada indikator fenolftalein.
Dari uji larutan dengan beberapa indikator, akan diperoleh daerah irisan pH larutan (dengan menggunakan garis bilangan). Daerah irisan tersebut menyatakan pH dari larutan E.
Dengan demikian, dapat disimpulkan pH larutan B pada percobaan kami yaitu >10. Dan karena larutan E memiliki pH <10 maka termasuk basa kuat.
VIII. Kesimpulan
Berdasarkan praktikum yang telah kami lakukan, dapat disimpulkan bahwa
· pH larutan A adalah 7,6<pH<8,3
· pH larutan B adalah <2,9
· pH larutan C adalah <2,9
· pH larutan D adalah 8,3<pH<10
· pH larutan E adalah <10
Daftar Pustaka
https://analisismu.blogspot.com/2016/09/laporan-praktikum-skala-ph-dan.html
https://www.pelajaran.co.id/2016/04/konsep-ph-poh-dan-pkw-pada-larutan-asam-basa.html





Komentar
Posting Komentar